Анализ современной лечебной тактики при заболеваниях суставов
А.Н. Беловол, член-корреспондент АМН Украины, д.м.н., профессор, И.И. Князькова, к.м.н., кафедра госпитальной терапии и клинической фармакологии Харьковского государственного медицинского университета
В практике терапевта больные заболеваниями опорно-двигательного аппарата встречаются достаточно часто. По данным International Association on the Study of Pain, каждый седьмой пациент, обращающийся за плановой амбулаторной помощью, предъявляет жалобы на боли в суставах. Особое значение данная проблема приобретает у лиц пожилого и старческого возраста.
Артрит (в соответствии с рекомендациями Американской ассоциации ревматологов) – это отек и ограничение подвижности в суставе в сочетании с гиперемией, болью или болезненностью при движении. Существует около 100 разнообразных причин полиартрита. Для постановки правильного диагноза может потребоваться несколько недель или месяцев. В данной статье будут представлены особенности лечебной тактики при деформирующем остеартрозе (ОА), ревматоидном артрите (РА) и подагре. Поскольку объединяющим клиническим признаком при этих заболеваниях является интенсивный болевой синдром, лечебные мероприятия прежде всего должны быть направлены на уменьшение степени его выраженности. С этой целью применяют лекарственные средства, оказывающие быстрый симптоматический эффект – нестероидные противовоспалительные препараты (НПВП).
НПВП различаются по степени выраженности противовоспалительного, анальгетического эффекта, индивидуальной чувствительности и переносимости пациентами, что определяет их выбор для каждого конкретного больного. В настоящее время класс НПВП включает около 30 лекарственных средств, которые различаются по химической структуре. Традиционные (неселективные) НПВП подавляют активность обеих изоформ циклооксигеназы (ЦОГ). В последние десятилетия был разработан ряд препаратов с разной степенью избирательности в отношении ЦОГ-2.
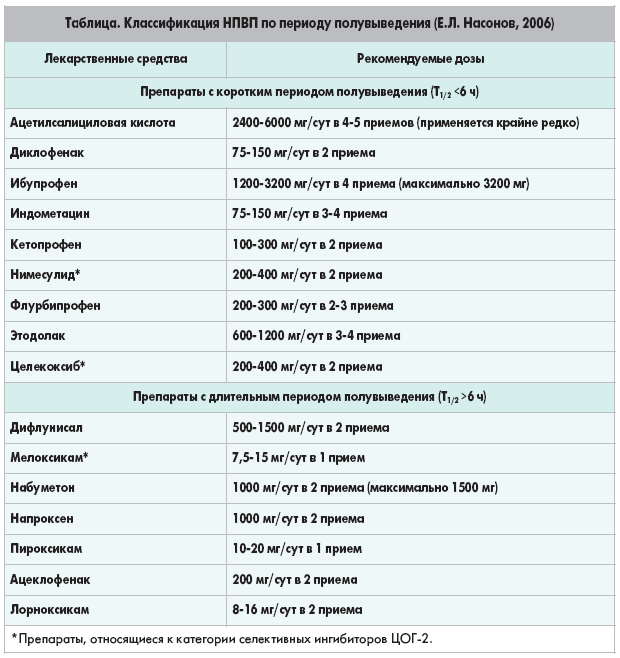
В клинической практике представляет интерес классификация НПВП в зависимости от периода полувыведения препаратов (табл.). При этом четкой связи между периодом полувыведения (Т1/2) НПВП в плазме и клинической эффективностью не прослеживается. Это связано с тем, что препараты с коротким Т1/2 накапливаются в зоне воспаления, например в полости сустава, поэтому двукратный их прием нередко столь же эффективен, как и многократный.
При назначении НПВП следует учитывать некоторые особенности их применения:
• анальгетический эффект проявляется через несколько часов;
• противовоспалительный эффект развивается через 2-3 нед;
• наличие индивидуальной чувствительности к НПВП;
• существование факторов, определяющих развитие побочных эффектов;
• влияние на сопутствующую терапию (сахароснижающие, дигоксин, метотрексат и др.).
Назначение НПВП для длительного лечения должно проводиться с учетом индивидуальной оценки баланса польза/риск (уровень доказательств А). При этом обязателен мониторинг клинических и лабораторных показателей с целью раннего выявления побочных эффектов.
Остеоартроз (ОА) – это гетерогенная группа заболеваний различной этиологии с одинаковыми биологическими, морфологическими и клиническими исходами, при которых в патологический процесс вовлекается не только суставной хрящ, но и все структуры сустава – субхондральная кость, связки, капсула, синовиальная мембрана и околосуставные мышцы.
Основные факторы патогенеза ОА:
– нарушение обмена хондроцитов и матрикса суставного хряща;
– нарушение структуры коллагена с уменьшением его устойчивости к механическим нагрузкам;
– иммунный механизм и воздействие цитокинов;
– нарушение кровообращения в суставных тканях (синовиальной оболочке, субхондральной кости);
– синовит.
Болевой синдром при ОА может быть обусловлен:
– развитием вторичного синовита;
– возникновением трабекулярных микропереломов;
– внутримедуллярной гипертензией;
– давлением на обнаженную субхондральную кость;
– спазмом околосуставных мышц;
– дегенеративными изменениями интраартрикулярных связок;
– наличием остеофитов;
– сосудистой патологией и др.
Ранняя стадия ОА асимптоматична. Пациенты обращаются к врачу при появлении клинических симптомов артропатии: боли, скованности (при отсутствии выраженной утренней скованности), снижении функции (увеличение выраженности боли к концу дня). При рентгенологическом обследовании выявляются неравномерное сужение суставной щели, субхондральный склероз, кистовидные просветления головок костей, единичные или множественные остеофиты. Эти данные свидетельствуют о развернутой картине болезни.
Задачи лечебных программ ОА включают:
– уменьшение болевого синдрома, подавление воспаления в суставах, улучшение функции пораженного сустава;
– снижение риска обострений;
– предотвращение мышечной гипотрофии, деформации и контрактуры суставов;
– улучшение качества жизни и предотвращение инвалидности.
В лечении ОА важное место занимают рекомендации по созданию щадящего для суставов двигательного режима, включающего, с одной стороны, адекватные механические нагрузки на суставы, а с другой – адекватную для данного пациента умеренную двигательную активность. Эффективность проводимой терапии может быть объективизирована и зарегистрирована при помощи специальных опросников в баллах или с использованием визуальной аналоговой шкалы, когда больной сам отмечает изменения уровня боли в покое или при движении.
Выделяют три группы системных препаратов, применяемых для лечения ОА:
– симптоматические средства быстрого действия – парацетамол (ацетаминофен), НПВП, трамадол;
– симптоматические препараты медленного действия, или симптоммодифицирующие препараты, – хондроитин, глюкозамин, препараты гиалуроновой кислоты;
– лекарственные средства, модифицирующие структуру хряща, или структурно-модифицирующие (базисные) препараты, – хондроитин, глюкозамин, комбинированные препараты.
Симптоматические средства быстрого действия направлены на купирование боли. При слабом или умеренном непостоянном болевом синдроме и при отсутствии четких признаков воспаления возможен периодический прием парацетамола в дозе не более 2 г/сут. В указанной дозе доказана безопасность применения парацетамола в течение двух лет. Следует помнить, что превышение указанной дозировки приводит к развитию побочных эффектов со стороны желудочно-кишечного тракта (ЖКТ). В исследовании В.А. Насоновой показано, что при лечении парацетамолом только 10% пациентов с ОА отметили улучшение и около 60% почувствовали ухудшение на фоне лечения.
При неэффективности парацетамола, а также наличии признаков воспаления показано назначение НПВП. Ниже представленны положения для применения НПВП при ОА.
При выборе НПВП для комплексного лечения ОА, кроме анальгетических свойств, необходимо учитывать их влияние на хрящ. Показано, что наиболее неблагоприятное влияние на хрящ при остеоартрозе, по данным рентгенологического исследования, оказывают производные индол/инденуксусной кислоты (индометацин), хотя и производные пропионовой кислоты (ибупрофен, напроксен и др.) также на 30% ускоряют рентгенологическое прогрессирование ОА.
Установлено, что неселективные НПВП снижают синтез глюкозаминогликанов, необходимых для регенерации хряща. Вместе с тем in vitro диклофенак натрия в концентрациях, эквивалентных тем, которые достигаются при лечении пациентов, не подавляет биосинтез протеогликанов хрящевой ткани. Селективные ингибиторы ЦОГ-2 (нимесулид, мелоксикам, целекоксиб) не влияют на синтез глюкозаминогликанов, но способны положительно влиять на ремоделирование костной ткани, так как активация остеокластов происходит при активном участии ЦОГ-2. В исследовании Н.Г. Иониченок с использованием магнитно-резонансной томографии, сонографии суставов, артроскопии было показано, что полуторагодичный прием мелоксикама в дозе 15 мг/сут с последующим снижением дозы до 7,5 мг оказывает не только анальгетический, но и структурно-модифицирующий эффект, замедляя прогрессирование хондропатии у пациентов с гонартрозом.
• Выбор препарата зависит от таких факторов, как безопасность, сочетаемость с другими препаратами, отсутствие негативного влияния на хрящ.
• Предпочтение следует отдавать препаратам короткого действия (например, производным арилуксусной (диклофенак и др.) кислоты.
• Применяют в дозах в 2-3 раза меньших, чем при артритах.
• Лечение НПВП должно проводиться по возможности в минимальной эффективной дозе и в течение не более 2-3 нед.
• Индивидуальный выбор наиболее эффективного препарата конкретному больному.
• Возможно местное применение НПВП в мазях и гелях.
• Назначение НПВП в соответствии с суточным ритмом развития болевого и воспалительного синдрома, а также особенностей фармакокинетики препаратов.
• Нецелесообразно комбинировать НПВП разных групп.
• В соответствии с проведенными исследованиями данных о преимуществе какого-либо одного НПВП над другими относительно обезболивающих свойств не получено.
• Целесообразно комбинировать НПВП с миорелаксантами и седативными препаратами.
Позитивное влияние на хрящ выявлено у коксибов. В исследовании, проведенном in vitro на хряще больных ОА, было изучено влияние целекоксиба на метаболизм хряща в сравнении с золотым стандартом НПВП – диклофенаком. Под влиянием целекоксиба наблюдалось увеличение числа молекул протеогликана, вновь синтезированных молекул гиалуроновой кислоты, торможение разрушения молекул, участвующих в синтезе гиалуроновой кислоты.
При неэффективности парацетамола или НПВП, а также невозможности назначения оптимальных доз этих лекарственных средств для купирования интенсивного болевого синдрома на короткий период назначается трамадол – препарат центрального действия опиоидного ряда. Показано, что у больных ОА II стадии, имеющих в анамнезе поражение ЖКТ, назначение трамадола в дозе 50 мг 2 раза в день в течение 10 дней приводило к уменьшению боли по визуальной аналоговой шкале в среднем на 45,7%. Важно отметить, что препарат действует на психоэмоциональный компонент болевой перцепции и при длительном применении в больших дозах может привести к толерантности, а также формированию психической и физической зависимости.
Симптоматические препараты медленного действия
При ОА важным является не только достижение обезболивающего эффекта, но и длительное лечение, направленное на улучшение функции основных тканей и структур сустава, что также способно привести к стойкому обезболивающему эффекту. С этой целью применяются так называемые базисные, или болезнь-модифицирующие, препараты, способствующие сохранению и восстановлению суставного хряща.
Обладая комплексным механизмом действия и тропностью к хрящу, хондроитин и глюкозамин встраиваются в структуры хрящевой ткани, стимулируя ее синтез и угнетая деструкцию. И хондроитин, и глюкозамин обладают собственным обезболивающим и противовоспалительным действием не за счет подавления синтеза простагландинов, а благодаря подавлению активности лизосомальных ферментов и ингибированию супероксидных радикалов. Положительное влияние на хрящ хондроитина и глюкозамина обусловлено подавлением катаболических процессов и стимуляцией анаболических процессов в хряще.
В исследованиях установлено, что глюкозамина сульфат и хондроитина сульфат в виде монопрепаратов уменьшают болевой синдром и функциональные нарушения в суставах при ОА. При этом эффект сохраняется в течение нескольких месяцев после их отмены. У пациентов с ОА коленных суставов установлено, что длительный прием (в течение трех лет) монопрепаратов хондроитина сульфата и глюкозамина сульфата сопровождается улучшением клинической симптоматики (симптоммодифицирующий эффект), замедлением сужения суставной щели и образования остеофитов по сравнению с плацебо (структурно-модифицирующий эффект). До сих пор нет единого мнения относительно того, связаны ли эффекты этих препаратов с хондропротекторным действием или являются результатом симптоматического анальгетического эффекта, способствующего более полноценному разгибанию колена.
Совместное применение хондроитина сульфата и глюкозамина гидрохлорида в эксперименте увеличивало продукцию глюкозаминогликанов хондроцитами на 96,6% по сравнению с 32% при монотерапии. В исследовании GAIT проведено изучение симптоммодифицирующего и структурно-модифицирующего эффектов глюкозамина гидрохлорида, хондроитина сульфата и их комбинации у больных ОА коленных суставов. Показано, что в целом по влиянию на болевой синдром глюкозамина гидрохлорид, хондроитина сульфат и их комбинация достоверно не отличались от группы плацебо. При этом у пациентов с умеренным и выраженным болевым синдромом терапия комбинацией глюкозамина гидрохлорида с хондроитина сульфатом в течение 6 мес приводила к достоверному анальгезирующему эффекту по сравнению с группой плацебо. Данные оценки структурно-модифицирующего действия на хрящевую ткань в исследовании GAIT пока не опубликованы.
Производные гиалуроновой кислоты
При ОА коленных суставов со стойким болевым синдромом и недостаточной эффективностью парацетамола и НПВП или наличии противопоказаний к их использованию показаны высокомолекулярные производные гиалуроната. Обязательным условием при применении этих препаратов является отсутствие признаков синовита. Производные гиалуроната выполняют амортизационную и лубрикационную (смазывающую) функции, являются субстратом для синтеза протеогликанов, защищают болевые рецепторы синовиальной оболочки от раздражения, улучшая свойства синовиальной жидкости, облегчают проникновение питательных веществ и веществ, необходимых для построения матрикса хряща. Производные гиалуроната применяют в виде внутрисуставных инъекций. Курс лечения – 3-5 инъекций высокомолекулярных препаратов в дозе, эквивалентной 25 мг гиалуроната натрия, с частотой 1 раз в неделю. Положительный эффект терапии сохраняется около 12 мес.
Показано, что внутрисуставное введение производных гиалуроновой кислоты эффективнее, чем плацебо, уменьшает болевой синдром и улучшает функцию суставов при низком количестве побочных эффектов. У пациентов со среднетяжелым и тяжелым ОА коленных суставов после 5 еженедельных инъекций 25 мг гиалуроната натрия отмечен отчетливый позитивный эффект по сравнению с плацебо, сохранявшийся в течение 13 нед. Эффективность применения внутрисуставных инъекций производных гиалуроната при ОА тазобедренных суставов не доказана.
Внутрисуставное введение кортикостероидов
Эта процедура показана пациентам при воспалительном процессе в коленном суставе, особенно если он сопровождается выпотом в суставе. Во время пункции сустава возможен забор синовиальной жидкости на исследование для исключения подагры или подтверждения воспалительного артрита, в частности РА. При ОА пункция суставной полости и введение лекарств связаны с особой сложностью, так как сустав деформирован (сужение суставной щели, фиброз капсулы, малое количество синовиальной жидкости в полости сустава, контрактуры). Решение о пункции коленного сустава и инъекции кортикостероидов должно приниматься после использования всех других неинвазивных методов лечения. Глюкокортикостероиды вводятся только при гонартрозе. При этом отмечается уменьшение боли и признаков воспаления в течение 1 нед. С этой целью применяют триамцинолон, метилпреднизолон, бетаметазон. Обычно используются препараты пролонгированного действия. Целесообразно использовать дозы глюкокортикостероидов, эквивалентные 40 мг триамцинолона. Одновременно возможно введение анестетиков (новокаина, лидокаина), действие которых на фоне глюкокортикостероидов потенцируется. Частоту введения не следует превышать более 2-3 в год. Глюкокортикостероиды снижают уровень клеточного метаболизма, подавляют клеточную пролиферацию, продукцию фосфолипазы А2 и интерлейкина-1, участвующего в деградации хряща. Частота интраартрикулярного введения глюкокортикостероидов ограничена из-за усиления остеопороза и отрицательного влияния на хрящ. Возможно, параартрикулярное введение глюкокортикостероидов, однако обезболивающий эффект будет менее продолжительным. Предпочтительно при этом вводить меньшее количество глюкокортикостероидов с увеличенной дозой анестетика.
Следует отметить, что при наличии у пациентов ночных болей, длительной утренней скованности или полиартрита обязательной является консультация ревматолога для исключения ревматологического заболевания, особенно в случае, если не получен ответ на стандартную терапию. При этом, возможно, потребуется комбинация методов лечения, включая артроцентез.
Важным направлением в лечении ОА является немедикаментозное лечение, которое предполагает проведение физической и трудовой терапии, программ лечебной физкультуры, определение потребности в ортопедических устройствах.
Физиотерапевтические методы лечения
При ОА физиотерапевтические методы лечения активизируют местное кровообращение в периартрикулярных тканях, уменьшают отек, устраняют рефлекторный мышечный спазм, таким образом оказывая обезболивающее действие. В период обострения болевого синдрома, обусловленного реактивным синовитом, используют ультрафиолетовое облучение, электрическое поле ультравысокой частоты, переменные магнитные поля низкой частоты, электрофорез лекарственных средств (тримекаин, новокаин, димексид и др.) на область пораженного сустава. В период стихания обострения, а также в начальной стадии заболевания при отсутствии или слабо выраженных признаках синовита применяются воздействия электромагнитными полями высоких и сверхвысоких частот (индуктотермия, дециметровая и сантиметровая волновая терапия); импульсные токи низкой частоты – синусоидальные и диадинамические; магнитотерапия, лазерное воздействие, фонофорез лекарственных средств (гидрокортизон). Для стимуляции трофики суставного хряща проводят электрофорез кальция и цинка. Для потенцирования обезболивающего действия применяют СМТ-форез новокаина и салициловой кислоты. При ОА с болевым синдромом без синовита, вазотрофических расстройствах, контрактурах показано местное применение холода или тепла, а также аппликации парафина и озокерита. При отсутствии синовита эффективны морские, радоновые, сульфидные, бишофитные и йодобромные ванны. С целью получения обезболивающего эффекта применяют ультразвуковую терапию. Чрескожная электростимуляция нервов имеет достоверный, но непродолжительный анальгетический эффект. Клиническая эффективность физиотерапии усиливается местным применением содержащих НПВП мазей, кремов и гелей. Имеются сообщения об эффективности в комплексной терапии ОА лазеротерапии.
Ортопедические мероприятия
При ОА ортопедические мероприятия не менее важны, чем медикаментозная терапия. Поскольку одной из причин развития и прогрессирования дегенеративных изменений в суставе является перегрузка суставного хряща, одним из способов лечения должна быть осевая разгрузка сустава. Больным не показана длительные ходьба, стояние на ногах, хождение по лестнице и ношение тяжестей. В каждом конкретном случае разрабатывается индивидуальная программа возможной физической нагрузки и мероприятий по профилактической разгрузке сустава. Среди специальных приспособлений используются повязки или наколенники, фиксирующие колено в вальгусном положении; ортопедические стельки, ортезы; хождение с тростью, причем в руке, противоположной пораженной нижней конечности. Следует отметить, что специальных исследований по этому поводу не проводилось, тем не менее применение трости внесено в международные рекомендации.
Доказано положительное влияние на болевой синдром и функцию при ОА физических тренировок. При этом занятия со специалистом по лечебной физкультуре и их регулярность более важны, чем выбор какого-либо определенного упражнения. Комплекс лечебной физкультуры направлен на повышение тонуса ослабленных групп мышц, усиление трофики пораженных суставов, улучшение функциональной способности пациента. Несмотря на то что доказательств эффективности применения акупунктуры при ОА до настоящего времени не получено, этот метод также может быть применен в комплексном лечении заболевания. Акупунктура при ОА не оказывает патогенетического воздействия, но позволяет уменьшить напряженность мышц, связанную с изменением подвижности сустава, уменьшая тем самым выраженность болевых проявлений. Обычно достаточно 3- или 4-недельного курса, чтобы определиться с целесообразностью дальнейшего проведения лечения этим методом.
Хирургические вмешательства
Показаниями к хирургическим вмешательствам при ОА является наличие неуправляемой изнуряющей боли и существенных ограничений функции сустава, в частности при ходьбе, ежедневной активности. При ОА выполняются такие паллиативные операции, как артротомия с санацией полости сустава от некротизированных элементов и остеотомия для ремодуляции осей нагрузок в суставе. В клиническом исследовании показано, что при наличии свободных костных или хрящевых фрагментов в полости сустава артроскопический лаваж коленных суставов с удалением этих тканей может улучшить функцию сустава и уменьшить «механические» симптомы. В систематическом обзоре R.W. Brouwer и соавт. (2005) показано, что проведение остеотомии приводит к уменьшению боли и улучшению функции сустава, что позволяет отсрочить плановое протезирование сустава на 5-10 лет. Эндопротезирование сустава показано больным ОА с выраженным болевым синдромом, не поддающимся консервативному лечению, выраженными рентгенологическими проявлениями ОА, при наличии серьезного нарушения функции сустава (до развития значительных деформаций, нестабильности сустава, контрактур и мышечной атрофии). При надлежащем отборе пациентов хорошие результаты могут быть получены в 95% случаев. В настоящее время обсуждаются преимущества остеотомии перед эндопротезированием коленного сустава, однако окончательный ответ будет получен в последующих клинических исследованиях.
В практике терапевта больные заболеваниями опорно-двигательного аппарата встречаются достаточно часто. По данным International Association on the Study of Pain, каждый седьмой пациент, обращающийся за плановой амбулаторной помощью, предъявляет жалобы на боли в суставах. Особое значение данная проблема приобретает у лиц пожилого и старческого возраста.
Артрит (в соответствии с рекомендациями Американской ассоциации ревматологов) – это отек и ограничение подвижности в суставе в сочетании с гиперемией, болью или болезненностью при движении. Существует около 100 разнообразных причин полиартрита. Для постановки правильного диагноза может потребоваться несколько недель или месяцев. В данной статье будут представлены особенности лечебной тактики при деформирующем остеартрозе (ОА), ревматоидном артрите (РА) и подагре. Поскольку объединяющим клиническим признаком при этих заболеваниях является интенсивный болевой синдром, лечебные мероприятия прежде всего должны быть направлены на уменьшение степени его выраженности. С этой целью применяют лекарственные средства, оказывающие быстрый симптоматический эффект – нестероидные противовоспалительные препараты (НПВП).
НПВП различаются по степени выраженности противовоспалительного, анальгетического эффекта, индивидуальной чувствительности и переносимости пациентами, что определяет их выбор для каждого конкретного больного. В настоящее время класс НПВП включает около 30 лекарственных средств, которые различаются по химической структуре. Традиционные (неселективные) НПВП подавляют активность обеих изоформ циклооксигеназы (ЦОГ). В последние десятилетия был разработан ряд препаратов с разной степенью избирательности в отношении ЦОГ-2.
В клинической практике представляет интерес классификация НПВП в зависимости от периода полувыведения препаратов (табл.). При этом четкой связи между периодом полувыведения (Т1/2) НПВП в плазме и клинической эффективностью не прослеживается. Это связано с тем, что препараты с коротким Т1/2 накапливаются в зоне воспаления, например в полости сустава, поэтому двукратный их прием нередко столь же эффективен, как и многократный.

При назначении НПВП следует учитывать некоторые особенности их применения:
• анальгетический эффект проявляется через несколько часов;
• противовоспалительный эффект развивается через 2-3 нед;
• наличие индивидуальной чувствительности к НПВП;
• существование факторов, определяющих развитие побочных эффектов;
• влияние на сопутствующую терапию (сахароснижающие, дигоксин, метотрексат и др.).
Назначение НПВП для длительного лечения должно проводиться с учетом индивидуальной оценки баланса польза/риск (уровень доказательств А). При этом обязателен мониторинг клинических и лабораторных показателей с целью раннего выявления побочных эффектов.
Остеоартроз (ОА) – это гетерогенная группа заболеваний различной этиологии с одинаковыми биологическими, морфологическими и клиническими исходами, при которых в патологический процесс вовлекается не только суставной хрящ, но и все структуры сустава – субхондральная кость, связки, капсула, синовиальная мембрана и околосуставные мышцы.
Основные факторы патогенеза ОА:
– нарушение обмена хондроцитов и матрикса суставного хряща;
– нарушение структуры коллагена с уменьшением его устойчивости к механическим нагрузкам;
– иммунный механизм и воздействие цитокинов;
– нарушение кровообращения в суставных тканях (синовиальной оболочке, субхондральной кости);
– синовит.
Болевой синдром при ОА может быть обусловлен:
– развитием вторичного синовита;
– возникновением трабекулярных микропереломов;
– внутримедуллярной гипертензией;
– давлением на обнаженную субхондральную кость;
– спазмом околосуставных мышц;
– дегенеративными изменениями интраартрикулярных связок;
– наличием остеофитов;
– сосудистой патологией и др.
Ранняя стадия ОА асимптоматична. Пациенты обращаются к врачу при появлении клинических симптомов артропатии: боли, скованности (при отсутствии выраженной утренней скованности), снижении функции (увеличение выраженности боли к концу дня). При рентгенологическом обследовании выявляются неравномерное сужение суставной щели, субхондральный склероз, кистовидные просветления головок костей, единичные или множественные остеофиты. Эти данные свидетельствуют о развернутой картине болезни.
Задачи лечебных программ ОА включают:
– уменьшение болевого синдрома, подавление воспаления в суставах, улучшение функции пораженного сустава;
– снижение риска обострений;
– предотвращение мышечной гипотрофии, деформации и контрактуры суставов;
– улучшение качества жизни и предотвращение инвалидности.
В лечении ОА важное место занимают рекомендации по созданию щадящего для суставов двигательного режима, включающего, с одной стороны, адекватные механические нагрузки на суставы, а с другой – адекватную для данного пациента умеренную двигательную активность. Эффективность проводимой терапии может быть объективизирована и зарегистрирована при помощи специальных опросников в баллах или с использованием визуальной аналоговой шкалы, когда больной сам отмечает изменения уровня боли в покое или при движении.
Выделяют три группы системных препаратов, применяемых для лечения ОА:
– симптоматические средства быстрого действия – парацетамол (ацетаминофен), НПВП, трамадол;
– симптоматические препараты медленного действия, или симптоммодифицирующие препараты, – хондроитин, глюкозамин, препараты гиалуроновой кислоты;
– лекарственные средства, модифицирующие структуру хряща, или структурно-модифицирующие (базисные) препараты, – хондроитин, глюкозамин, комбинированные препараты.
Симптоматические средства быстрого действия направлены на купирование боли. При слабом или умеренном непостоянном болевом синдроме и при отсутствии четких признаков воспаления возможен периодический прием парацетамола в дозе не более 2 г/сут. В указанной дозе доказана безопасность применения парацетамола в течение двух лет. Следует помнить, что превышение указанной дозировки приводит к развитию побочных эффектов со стороны желудочно-кишечного тракта (ЖКТ). В исследовании В.А. Насоновой показано, что при лечении парацетамолом только 10% пациентов с ОА отметили улучшение и около 60% почувствовали ухудшение на фоне лечения.
При неэффективности парацетамола, а также наличии признаков воспаления показано назначение НПВП. Ниже представленны положения для применения НПВП при ОА.
При выборе НПВП для комплексного лечения ОА, кроме анальгетических свойств, необходимо учитывать их влияние на хрящ. Показано, что наиболее неблагоприятное влияние на хрящ при остеоартрозе, по данным рентгенологического исследования, оказывают производные индол/инденуксусной кислоты (индометацин), хотя и производные пропионовой кислоты (ибупрофен, напроксен и др.) также на 30% ускоряют рентгенологическое прогрессирование ОА.
Установлено, что неселективные НПВП снижают синтез глюкозаминогликанов, необходимых для регенерации хряща. Вместе с тем in vitro диклофенак натрия в концентрациях, эквивалентных тем, которые достигаются при лечении пациентов, не подавляет биосинтез протеогликанов хрящевой ткани. Селективные ингибиторы ЦОГ-2 (нимесулид, мелоксикам, целекоксиб) не влияют на синтез глюкозаминогликанов, но способны положительно влиять на ремоделирование костной ткани, так как активация остеокластов происходит при активном участии ЦОГ-2. В исследовании Н.Г. Иониченок с использованием магнитно-резонансной томографии, сонографии суставов, артроскопии было показано, что полуторагодичный прием мелоксикама в дозе 15 мг/сут с последующим снижением дозы до 7,5 мг оказывает не только анальгетический, но и структурно-модифицирующий эффект, замедляя прогрессирование хондропатии у пациентов с гонартрозом.
• Выбор препарата зависит от таких факторов, как безопасность, сочетаемость с другими препаратами, отсутствие негативного влияния на хрящ.
• Предпочтение следует отдавать препаратам короткого действия (например, производным арилуксусной (диклофенак и др.) кислоты.
• Применяют в дозах в 2-3 раза меньших, чем при артритах.
• Лечение НПВП должно проводиться по возможности в минимальной эффективной дозе и в течение не более 2-3 нед.
• Индивидуальный выбор наиболее эффективного препарата конкретному больному.
• Возможно местное применение НПВП в мазях и гелях.
• Назначение НПВП в соответствии с суточным ритмом развития болевого и воспалительного синдрома, а также особенностей фармакокинетики препаратов.
• Нецелесообразно комбинировать НПВП разных групп.
• В соответствии с проведенными исследованиями данных о преимуществе какого-либо одного НПВП над другими относительно обезболивающих свойств не получено.
• Целесообразно комбинировать НПВП с миорелаксантами и седативными препаратами.
Позитивное влияние на хрящ выявлено у коксибов. В исследовании, проведенном in vitro на хряще больных ОА, было изучено влияние целекоксиба на метаболизм хряща в сравнении с золотым стандартом НПВП – диклофенаком. Под влиянием целекоксиба наблюдалось увеличение числа молекул протеогликана, вновь синтезированных молекул гиалуроновой кислоты, торможение разрушения молекул, участвующих в синтезе гиалуроновой кислоты.
При неэффективности парацетамола или НПВП, а также невозможности назначения оптимальных доз этих лекарственных средств для купирования интенсивного болевого синдрома на короткий период назначается трамадол – препарат центрального действия опиоидного ряда. Показано, что у больных ОА II стадии, имеющих в анамнезе поражение ЖКТ, назначение трамадола в дозе 50 мг 2 раза в день в течение 10 дней приводило к уменьшению боли по визуальной аналоговой шкале в среднем на 45,7%. Важно отметить, что препарат действует на психоэмоциональный компонент болевой перцепции и при длительном применении в больших дозах может привести к толерантности, а также формированию психической и физической зависимости.
Симптоматические препараты медленного действия
При ОА важным является не только достижение обезболивающего эффекта, но и длительное лечение, направленное на улучшение функции основных тканей и структур сустава, что также способно привести к стойкому обезболивающему эффекту. С этой целью применяются так называемые базисные, или болезнь-модифицирующие, препараты, способствующие сохранению и восстановлению суставного хряща.
Обладая комплексным механизмом действия и тропностью к хрящу, хондроитин и глюкозамин встраиваются в структуры хрящевой ткани, стимулируя ее синтез и угнетая деструкцию. И хондроитин, и глюкозамин обладают собственным обезболивающим и противовоспалительным действием не за счет подавления синтеза простагландинов, а благодаря подавлению активности лизосомальных ферментов и ингибированию супероксидных радикалов. Положительное влияние на хрящ хондроитина и глюкозамина обусловлено подавлением катаболических процессов и стимуляцией анаболических процессов в хряще.
В исследованиях установлено, что глюкозамина сульфат и хондроитина сульфат в виде монопрепаратов уменьшают болевой синдром и функциональные нарушения в суставах при ОА. При этом эффект сохраняется в течение нескольких месяцев после их отмены. У пациентов с ОА коленных суставов установлено, что длительный прием (в течение трех лет) монопрепаратов хондроитина сульфата и глюкозамина сульфата сопровождается улучшением клинической симптоматики (симптоммодифицирующий эффект), замедлением сужения суставной щели и образования остеофитов по сравнению с плацебо (структурно-модифицирующий эффект). До сих пор нет единого мнения относительно того, связаны ли эффекты этих препаратов с хондропротекторным действием или являются результатом симптоматического анальгетического эффекта, способствующего более полноценному разгибанию колена.
Совместное применение хондроитина сульфата и глюкозамина гидрохлорида в эксперименте увеличивало продукцию глюкозаминогликанов хондроцитами на 96,6% по сравнению с 32% при монотерапии. В исследовании GAIT проведено изучение симптоммодифицирующего и структурно-модифицирующего эффектов глюкозамина гидрохлорида, хондроитина сульфата и их комбинации у больных ОА коленных суставов. Показано, что в целом по влиянию на болевой синдром глюкозамина гидрохлорид, хондроитина сульфат и их комбинация достоверно не отличались от группы плацебо. При этом у пациентов с умеренным и выраженным болевым синдромом терапия комбинацией глюкозамина гидрохлорида с хондроитина сульфатом в течение 6 мес приводила к достоверному анальгезирующему эффекту по сравнению с группой плацебо. Данные оценки структурно-модифицирующего действия на хрящевую ткань в исследовании GAIT пока не опубликованы.
Производные гиалуроновой кислоты
При ОА коленных суставов со стойким болевым синдромом и недостаточной эффективностью парацетамола и НПВП или наличии противопоказаний к их использованию показаны высокомолекулярные производные гиалуроната. Обязательным условием при применении этих препаратов является отсутствие признаков синовита. Производные гиалуроната выполняют амортизационную и лубрикационную (смазывающую) функции, являются субстратом для синтеза протеогликанов, защищают болевые рецепторы синовиальной оболочки от раздражения, улучшая свойства синовиальной жидкости, облегчают проникновение питательных веществ и веществ, необходимых для построения матрикса хряща. Производные гиалуроната применяют в виде внутрисуставных инъекций. Курс лечения – 3-5 инъекций высокомолекулярных препаратов в дозе, эквивалентной 25 мг гиалуроната натрия, с частотой 1 раз в неделю. Положительный эффект терапии сохраняется около 12 мес.
Показано, что внутрисуставное введение производных гиалуроновой кислоты эффективнее, чем плацебо, уменьшает болевой синдром и улучшает функцию суставов при низком количестве побочных эффектов. У пациентов со среднетяжелым и тяжелым ОА коленных суставов после 5 еженедельных инъекций 25 мг гиалуроната натрия отмечен отчетливый позитивный эффект по сравнению с плацебо, сохранявшийся в течение 13 нед. Эффективность применения внутрисуставных инъекций производных гиалуроната при ОА тазобедренных суставов не доказана.
Внутрисуставное введение кортикостероидов
Эта процедура показана пациентам при воспалительном процессе в коленном суставе, особенно если он сопровождается выпотом в суставе. Во время пункции сустава возможен забор синовиальной жидкости на исследование для исключения подагры или подтверждения воспалительного артрита, в частности РА. При ОА пункция суставной полости и введение лекарств связаны с особой сложностью, так как сустав деформирован (сужение суставной щели, фиброз капсулы, малое количество синовиальной жидкости в полости сустава, контрактуры). Решение о пункции коленного сустава и инъекции кортикостероидов должно приниматься после использования всех других неинвазивных методов лечения. Глюкокортикостероиды вводятся только при гонартрозе. При этом отмечается уменьшение боли и признаков воспаления в течение 1 нед. С этой целью применяют триамцинолон, метилпреднизолон, бетаметазон. Обычно используются препараты пролонгированного действия. Целесообразно использовать дозы глюкокортикостероидов, эквивалентные 40 мг триамцинолона. Одновременно возможно введение анестетиков (новокаина, лидокаина), действие которых на фоне глюкокортикостероидов потенцируется. Частоту введения не следует превышать более 2-3 в год. Глюкокортикостероиды снижают уровень клеточного метаболизма, подавляют клеточную пролиферацию, продукцию фосфолипазы А2 и интерлейкина-1, участвующего в деградации хряща. Частота интраартрикулярного введения глюкокортикостероидов ограничена из-за усиления остеопороза и отрицательного влияния на хрящ. Возможно, параартрикулярное введение глюкокортикостероидов, однако обезболивающий эффект будет менее продолжительным. Предпочтительно при этом вводить меньшее количество глюкокортикостероидов с увеличенной дозой анестетика.
Следует отметить, что при наличии у пациентов ночных болей, длительной утренней скованности или полиартрита обязательной является консультация ревматолога для исключения ревматологического заболевания, особенно в случае, если не получен ответ на стандартную терапию. При этом, возможно, потребуется комбинация методов лечения, включая артроцентез.
Важным направлением в лечении ОА является немедикаментозное лечение, которое предполагает проведение физической и трудовой терапии, программ лечебной физкультуры, определение потребности в ортопедических устройствах.
Физиотерапевтические методы лечения
При ОА физиотерапевтические методы лечения активизируют местное кровообращение в периартрикулярных тканях, уменьшают отек, устраняют рефлекторный мышечный спазм, таким образом оказывая обезболивающее действие. В период обострения болевого синдрома, обусловленного реактивным синовитом, используют ультрафиолетовое облучение, электрическое поле ультравысокой частоты, переменные магнитные поля низкой частоты, электрофорез лекарственных средств (тримекаин, новокаин, димексид и др.) на область пораженного сустава. В период стихания обострения, а также в начальной стадии заболевания при отсутствии или слабо выраженных признаках синовита применяются воздействия электромагнитными полями высоких и сверхвысоких частот (индуктотермия, дециметровая и сантиметровая волновая терапия); импульсные токи низкой частоты – синусоидальные и диадинамические; магнитотерапия, лазерное воздействие, фонофорез лекарственных средств (гидрокортизон). Для стимуляции трофики суставного хряща проводят электрофорез кальция и цинка. Для потенцирования обезболивающего действия применяют СМТ-форез новокаина и салициловой кислоты. При ОА с болевым синдромом без синовита, вазотрофических расстройствах, контрактурах показано местное применение холода или тепла, а также аппликации парафина и озокерита. При отсутствии синовита эффективны морские, радоновые, сульфидные, бишофитные и йодобромные ванны. С целью получения обезболивающего эффекта применяют ультразвуковую терапию. Чрескожная электростимуляция нервов имеет достоверный, но непродолжительный анальгетический эффект. Клиническая эффективность физиотерапии усиливается местным применением содержащих НПВП мазей, кремов и гелей. Имеются сообщения об эффективности в комплексной терапии ОА лазеротерапии.
Ортопедические мероприятия
При ОА ортопедические мероприятия не менее важны, чем медикаментозная терапия. Поскольку одной из причин развития и прогрессирования дегенеративных изменений в суставе является перегрузка суставного хряща, одним из способов лечения должна быть осевая разгрузка сустава. Больным не показана длительные ходьба, стояние на ногах, хождение по лестнице и ношение тяжестей. В каждом конкретном случае разрабатывается индивидуальная программа возможной физической нагрузки и мероприятий по профилактической разгрузке сустава. Среди специальных приспособлений используются повязки или наколенники, фиксирующие колено в вальгусном положении; ортопедические стельки, ортезы; хождение с тростью, причем в руке, противоположной пораженной нижней конечности. Следует отметить, что специальных исследований по этому поводу не проводилось, тем не менее применение трости внесено в международные рекомендации.
Доказано положительное влияние на болевой синдром и функцию при ОА физических тренировок. При этом занятия со специалистом по лечебной физкультуре и их регулярность более важны, чем выбор какого-либо определенного упражнения. Комплекс лечебной физкультуры направлен на повышение тонуса ослабленных групп мышц, усиление трофики пораженных суставов, улучшение функциональной способности пациента. Несмотря на то что доказательств эффективности применения акупунктуры при ОА до настоящего времени не получено, этот метод также может быть применен в комплексном лечении заболевания. Акупунктура при ОА не оказывает патогенетического воздействия, но позволяет уменьшить напряженность мышц, связанную с изменением подвижности сустава, уменьшая тем самым выраженность болевых проявлений. Обычно достаточно 3- или 4-недельного курса, чтобы определиться с целесообразностью дальнейшего проведения лечения этим методом.
Хирургические вмешательства
Показаниями к хирургическим вмешательствам при ОА является наличие неуправляемой изнуряющей боли и существенных ограничений функции сустава, в частности при ходьбе, ежедневной активности. При ОА выполняются такие паллиативные операции, как артротомия с санацией полости сустава от некротизированных элементов и остеотомия для ремодуляции осей нагрузок в суставе. В клиническом исследовании показано, что при наличии свободных костных или хрящевых фрагментов в полости сустава артроскопический лаваж коленных суставов с удалением этих тканей может улучшить функцию сустава и уменьшить «механические» симптомы. В систематическом обзоре R.W. Brouwer и соавт. (2005) показано, что проведение остеотомии приводит к уменьшению боли и улучшению функции сустава, что позволяет отсрочить плановое протезирование сустава на 5-10 лет. Эндопротезирование сустава показано больным ОА с выраженным болевым синдромом, не поддающимся консервативному лечению, выраженными рентгенологическими проявлениями ОА, при наличии серьезного нарушения функции сустава (до развития значительных деформаций, нестабильности сустава, контрактур и мышечной атрофии). При надлежащем отборе пациентов хорошие результаты могут быть получены в 95% случаев. В настоящее время обсуждаются преимущества остеотомии перед эндопротезированием коленного сустава, однако окончательный ответ будет получен в последующих клинических исследованиях.
Иллюстрация к статье:
Самые свежие новости медицины на нашей странице в Вконтакте
http://www.health-ua.com - Добавил v.v. в категорию Ревматология

Добавить комментарий