Специфическая аллерговакцинация при атопических заболеваниях
В.Ф. Лапшин, д.м.н., профессор, Т.Р. Уманец, к.м.н., Институт педиатрии, акушерства и гинекологии АМН Украины, г. Киев
По данным эпидемиологических исследований, атопические (IgE-зависимые) заболевания, такие как атопическая форма бронхиальной астмы, аллергический риноконъюнктивит, крапивница, поллиноз, инсектная аллергия, встречаются у 40-45% населения, причем количество больных во всем мире каждые десять лет удваивается.
Значительные успехи, достигнутые в терапии аллергических заболеваний в последние десятилетия, позволяют хорошо контролировать клиническое состояние больных на протяжении многих лет. Однако фармакотерапия не позволяет полностью излечить больного и изменить прогноз развития респираторной аллергии.
Среди современных методов лечения атопических заболеваний наиболее эффективным является специфическая иммунотерапия аллергенами – аллерговакцинация (САВ). Это единственный метод лечения, способный изменить патофизиологические механизмы атопических заболеваний, остановить формирование более тяжелых их форм на фоне снижения потребления антиаллергических фармакологических препаратов, продлить стойкую ремиссию, а также предотвратить расширение спектра аллергенов, к которым может развиваться сенсибилизация.
Метод CАВ основан на введении в организм больного возрастающих доз аллергена (аллергенной вакцины), к которому установлена повышенная чувствительность, что приводит к уменьшению или полному исчезновению клинических симптомов заболевания.
Всемирная организация здравоохранения совместно с ведущими ассоциациями аллергологов рекомендует вместо терминов «специфическая гипосенсибилизация», «специфическая иммунотерапия», «аллергенспецифическая иммунотерапия» использовать для названия метода иммунотерапии аллергических заболеваний следующие определения: «иммунотерапия аллергенами», «специфическая вакцинация аллергии», «специфическая аллерговакцинация» (WHO Position paper in Allergen Immunotherapy: Therapeutic vaccines for allergic diseases, 1997).
Чтобы приобрести знания, необходимые для проведения САВ, человечеству потребовалось почти 100 лет. В 1819 г. Босток, страдавший сезонным аллергическим ринитом, описал его как сенную лихорадку, предполагая, что заболевание как-то связано с сеном. В 1869 г. Блекли, пытаясь выяснить причину обострений сенной лихорадки, поставил на себе первые кожные пробы, нанося пыльцу на участки кожи с поврежденным эпидермисом. Быстрое развитие воспаления доказало связь сенной лихорадки с пыльцой растений. Эту связь после Блекли многим исследователям пришлось открывать заново. В 1902-1905 гг. Праустниц и Дунбар, страдающие сенной лихорадкой, в сериях экспериментов на себе также пытались выяснить природу этого заболевания и разработать методы лечения. Они получили лошадиную антисыворотку против пыльцы, но потерпели неудачу из-за развития сывороточной болезни. Уже эти эксперименты выявили основные проблемы, связанные с САВ, – возможность тяжелых побочных реакций и сложность дозирования аллергена, которые и были причиной неудач большинства попыток лечебного применения аллергенов. Разрешить эти проблемы удалось английским исследователям Леонарду Нуну и Джону Фримену, которым принадлежит первая публикация в журнале Lancet за 1911 г. о лечебном применении специфической иммунотерапии у 20 больных сенной лихорадкой.
Впервые иммунотерапия аллергенами при астме была использована Кауфилдом в 1921 г.
Т.Р. УманецИммунотерапия аллергенами показана при поллинозе, атопической форме бронхиальной астмы, аллергическом рините, конъюнктивите, инсектной аллергии в фазу ремиссии, когда невозможно прекратить контакт больного с причинно-значимым аллергеном. Необходимыми условиями для проведения САВ являются:
· четкое подтверждение роли аллергена (пыльца растений, бытовые аллергены, клещи домашней пыли, яд перепончатокрылых, грибы, бактерии);
· подтверждение IgE-зависимого механизма сенсибилизации;
· ограниченный спектр причинно-значимых аллергенов (не более трех);
· возраст от 5 до 50 лет.
При лекарственной аллергии САВ назначается крайне редко, в тех случаях, когда препарат жизненно необходим больному (например, инсулин при сахарном диабете). При пищевой аллергии продукт исключается из рациона питания. При эпидермальной аллергии САВ показана в тех случаях, когда исключение контакта с животным связано с изменением профессии (зоотехники, ветеринары, лаборанты и т.п.) или тяжелой психологической травмой при расставании с животным.
Эффективность метода снижается при низкой индивидуальной мотивации пациента, большой продолжительности аллергического заболевания, у пациентов старше 50 лет, при значительных вентиляционных нарушениях (показатели ниже 70% от должных величин); при поливалентной аллергии.
Противопоказаниями к проведению САВ являются: обострение основного аллергического заболевания, наличие выраженных осложнений основного аллергического процесса (эмфизема легких, пневмосклероз), легочное сердце с явлениями хронической дыхательной или сердечной недостаточности, беременность, опухоли, хронические инфекции в стадии обострения (туберкулез, бруцеллез, сифилис и др.), аутоиммунные заболевания (ревматизм в фазе обострения, коллагенозы и т.д.), тяжелые заболевания внутренних органов, нервной и эндокринной систем с нарушением их функций (например, язвенная болезнь желудка и двенадцатиперстной кишки, панкреатит, гепатит, цирроз печени, гломерулонефрит, декомпенсированный сахарный диабет, облитерирующий эндартериит, рассеянный склероз), психические заболевания в фазе обострения, острые инфекционные заболевания, заболевания крови.
Несмотря на то что САВ применяется более 80 лет, механизмы ее полностью не выяснены и продолжают уточняться. Многие исследователи связывают эффект САВ с увеличением концентрации IgG4, IgG1 и уменьшением синтеза IgE.
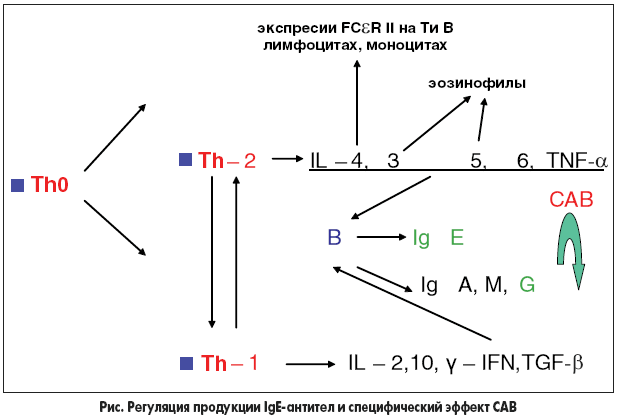
В соответствии с современными представлениями продукция IgE или IgG при иммунном ответе определяется хелперными Т-лимфоцитами (Th- или CD4+ лимфоциты), которые в результате распознавания антигена могут дифференцироваться из Th-0 в Th-клетки 1 или 2 типа. Th-1 опосредованный вариант ответа приводит к продукции IgG-антител. Цитокины Th-1 (интерлейкин-2 и интерферон) способствуют дифференцировке Th-0 в Th-1 и подавляют образование Th-2. При атопии наблюдается преимущественная дифференцировка пролиферирующих Th-0 лимфоцитов в Th-2. Th-2 клетки участвуют в запуске и поддержании продукции IgE-антител. Th-2, тучные клетки, эозинофилы с помощью сходного профиля цитокинов (IL-4, IL-5, IL-13), мембраносвязанных молекул (gp 39) и секретируемых В-лимфоцитами IgE-антител создают сеть взаимонаправленных позитивных сигналов, поддерживающих аллергическое воспаление. Цитокины Th-2 (IL-4, IL-13, IL-5) способствуют дифференцировке Th-2 и подавляют Th-1.
При САВ отмечается повышение содержания клеток, продуцирующих IL-12, усиление экспрессии HLA-DR (антигенпредставляющие клетки), появление рецепторов для IL-2, появление Th-1 клеток, переключение Th-2 ответа на Th-1 ответ, что приводит к переключению с IgE-иммунного ответа на IgG-ответ, то есть к запуску и поддержанию продукции IgG-антител (блокирующих) или формированию Т-лимфоцитарной толерантности. Степень соответствия САВ классическим моделям толерантности остается предметом изучения и дискуссий. САВ действует практически на все патогенетически значимые звенья аллергического процесса, оказывает тормозящее действие на клеточный и медиаторный компоненты аллергического воспаления, тормозит раннюю и позднюю фазу IgE-опосредованной аллергии. САВ оказывает действие на вызванную аллергеном продукцию цитокинов воспаления, включая IL-4 и интерферон. При САВ угнетаются эффекторные звенья аллергического процесса: уменьшается содержание тучных клеток, угнетается накопление клеток воспаления (эозинофилов и нейтрофилов), что, в свою очередь, приводит к угнетению накопления в тканях организма больного медиаторов воспаления, высвобождаемых из этих клеток, к уменьшению секреции хемотаксических посредников, инициирующих позднюю фазу аллергического воспаления и неспецифическую тканевую реактивность. Возникающие при САВ изменения характера представительства цитокиновых маркеров, снижение тканевой (органной) чувствительности к экспозиции аллергена, снижение неспецифической тканевой гиперреактивности, угнетение признаков аллергического воспаления сохраняются на протяжении длительного времени.
Ряд исследователей подтвердили важную роль в механизмах САВ секреторных IgА- и IgG-антител, которым также отводится роль блокирующих антител, причем их уровень возрастает при применении локальных методов аллерговакцинации. В процессе САВ возможно образование антиизотипических антител, то есть анти-IgЕ-антител.
Совокупность перечисленных механизмов определяет специфический компонент аллерговакцинации.
Однако наряду с иммунологическими механизмами САВ возможны и неиммунологические. Это прежде всего активация ферментных систем клеток и тканей, усиление их роли в деградации и утилизации аллергенов. В пользу неиммунологических механизмов САВ свидетельствует возможность десенсибилизации аспирином при аспириновой астме. По-видимому, успех десенсибилизации обусловлен биохимическими механизмами, уменьшающими биологические эффекты лейкотриенов, возникающие вследствие нарушения метаболизма арахидоновой кислоты.
Таким образом, преимущества САВ обусловлены терапевтическим действием, которое распространяется на все этапы аллергического ответа; такая широта отсутствует у известных фармакологических препаратов.
Анализ данных о САВ показывает, что эффективность метода может быть вариабельной и зависит от вида сенсибилизации, свойств и числа вводимых аллергенов, способа их введения, количества курсов лечения и других факторов.
С целью повышения клинической эффективности аллерговакцинации и уменьшения риска развития побочных реакций современные исследования направлены на улучшение качества аллергенов. Качество аллергенной вакцины имеет решающее значение как для диагностики, так и для лечения. По возможности для иммунотерапии аллергенами должны быть использованы стандартизированные вакцины с известной силой действия и с учетом срока годности.
Аллергенные вакцины (терапевтические вакцины для аллергических заболеваний) представляют собой очищенные водно-солевые экстракты аллергенов или выделенные из них отдельные аллергенные компоненты. В соответствии с требованиями Европейской фармакопейной конвенции, позицией ВОЗ и Комитета по стандартизации аллергенов при Международном Союзе иммунологических обществ терапевтические вакцины для аллергических заболеваний стандартизируются по своей биологической активности (международные единицы – МЕ). С целью контроля качества аллергенов для лечения используются международные эталоны или внутренние референс-препараты (in house reference – IHR). Стандартизация аллергенной активности основана на тестах in vitro, определяющих IgE-ответ, и на тестах in vivo – кожные пробы с учетом гистаминового эквивалента.
Для дозирования лечебных доз применяют единицы NOON (объем АГ, который экстрагируют из 1 мкг пыльцы), общего (TNU) или белкового (PNU) азота. 1 PNU равна 0,00001 мг белкового азота в 1 мл. Примерная эквивалентность 1 PNU = 2,6 TNU = 2 ед. NOON.
Проводится систематическая идентификация аллергенов различного происхождения. В настоящее время общий список аллергенов и описание их свойств размещены на сайте www.allergen.org.
С целью усиления иммуногенных свойств лечебных вакцин для лечения аллергических заболеваний используют аллергены пролонгированного действия с использованием природных и синтетических носителей, депонированные на L-тирозине, гидроокиси алюминия; аллергоиды (аллергены, модифицированные полимеризацией формальдегидом, глутаровым альдегидом и др.). При этом основной задачей модификации молекулы вакцины является снижение способности связываться со специфическими IgE (снижение аллергенности) при сохранении или даже повышении эффективного связывания с эпитопами Т-клеток, которое определяет иммуногенность молекулы.
В последние годы для проведения специфической вакцинации используют конъюгаты очищенных аллергенов с синтетическими высокомолекулярными носителями, например полиоксидонием (Р.В. Петров и соавт.), сукцинилированные (обработанные янтарной кислотой) и потенцированные ферментами (β-глюкуронидазой) препараты; изучаются возможности применения аллерген-IgG-содержащих комплексов, IgE-связывающих аллергенных гаптенов, Fab-фрагментов моноклональных анти-IgE-антител, фрагментов молекул аллергенов, сохраняющих Т-клеточные эпитопы (использование десенсибилизации, потенцированной ферментом enzyme-potentiated desensitization – EPD).
Еще одним принципиально новым направлением САВ является вакцинация ДНК, кодирующей аллерген. ДНК-вакцинация вызывает преимущественно ответ по Тh-1-типу. Вместе с тем имеются опасения, что слишком интенсивное образование аллергена трансфецированными клетками может приводить к анафилаксии. Хотя большая часть описанных выше биотехнологических подходов к созданию аллергенов для САВ носит экспериментальный характер, часть разработок уже завершилась созданием применяемых в клинике препаратов. Это вакцины серии Pollinex Quattro (Allergy Therapeutics), Allergovit (Allergopharma). Модификация аллергенов дает возможность сократить длительность курса иммунотерапии
до 4-8 инъекций, в то время как при использовании обычных немодифицированных вакцин курс лечения требует
от 16 до 50 инъекций.
В Украине выпуск стандартизированных препаратов аллергенов налажен в Виннице предприятием «Иммунолог» под руководством профессора Б.М. Пухлика, что обеспечивает возможность широкого применения аллергенов для диагностики и САВ.
Основной опасностью иммунотерапии аллергенами являются анафилактические реакции. Следовательно, иммунотерапия аллергенами должна проводиться только в аллергологических кабинетах под наблюдением врача-аллерголога, который может распознать ранние симптомы и признаки анафилактической реакции и назначить соответствующую неотложную терапию.
Различают местные и общие побочные реакции при проведении САВ. Общие побочные реакции обычно связаны с нарушением правил проведения САВ: превышение дозы вводимого аллергена, проведение лечения необученным персоналом, неправильная техника введения аллергена, попадание аллергена непосредственно в сосуд, введение аллерговакцины на фоне недиагностированной интеркуррентной инфекции, отсутствие контроля за жизненно важными показателями перед вакцинацией (АД, пульс, фоновый уровень пика экспираторного потока). Они должны быть конституциональными и системными. Последние развиваются через 10-40 мин после инъекции аллергена и проявляются симптомами разной степени тяжести: от умеренно выраженных (кашля, чихания, головной боли, крапивницы, отека лица) до синдромной реакции со стороны шоковых органов (конъюнктивита, ринита, приступа бронхиальной астмы). Частота общих реакций колеблется от 0,1 до 21%. Конституциональная реакция может проявляться анафилактическим шоком. Летальные случаи при правильном проведении САВ – казуистика. Но в Великобритании, где САВ проводили врачи общей практики, а не аллергологи, с 1957 по 1986 год описано 26 летальных исходов вследствие САВ. Наступление летальных исходов связано с несвоевременным началом антианафилактических мероприятий, отсутствием противошокового набора.
Местные побочные реакции выражаются образованием на месте инъекции отека, иногда обширного, безболезненного, с явлениями легкого зуда и гиперемии. Опасности для пациента они не представляют, проходят самостоятельно под действием антигистаминных средств и/или локальных глюкокортикостероидов в течение нескольких часов. Частота возникновения – до 25-35%.
В зависимости от способа введения аллергена различают подкожный, внутрикожный, аппликационный методы и метод кожных квадратов; оральную, сублингвальную, интраназальную, конъюнктивальную, ингаляционную САВ. В настоящее время единственным методом САВ, одобренным FDA, является подкожный.
На современном этапе большое внимание уделяется пероральным методам введения аллергена, особенно сублингвальному, который позволяет значительно снизить вероятность развития побочных реакций при САВ. Анализ литературных данных позволяет выделить ряд преимуществ сублингвальной САВ: высокая эффективность и безопасность лечения, удешевление за счет отмены инъекционных процедур, удобство и безболезненность лечения, высокий комплайенс врача и пациента.
В зависимости от продолжительности курсов выделяют круглогодичную, предсезонную, сезонную САВ, выбор определяется этиологией аллергического заболевания.
При бытовой аллергии проводят круглогодичное лечение. Предсезонную САВ используют преимущественно при поллинозах и всегда – при аллергических реакциях на укусы насекомых. Круглогодичное введение пыльцевых аллергенов (с уменьшением дозы вводимого аллергена в период поллинации) дает лучший клинический эффект.
Для каждого больного после тщательной аллергодиагностики подбирается индивидуальная схема лечения. Классический метод заключается в подкожном введении вне периода обострения аллергена серийного производства, содержащего в 1 мл 10 000-20 000 PNU. Начальная доза подбирается путем аллергометрического титрования. Аллерген в разведении с 10-6 до 10-4 вводится в дозе 0,1-0,2-0,4-0,8 мл ежедневно или через день. Затем следуют разведения от 10-3 до 10-1 в дозе 0,1-0,2-0,3-0,4-0,5-0,6-0,7-0,8-0,9 мл с интервалами 7-10 дней с последующим введением поддерживающей дозы (как правило, 1000-1500 ед.). Особенно удобным для больного является метод ускоренной САВ, позволяющий сократить сроки аллерговакцинации. Эта методика проводится только в условиях стационара.
САВ хорошо сочетается с базисной и симптоматической терапией аллергических заболеваний (антигистаминные препараты, кромогликат, недокромил, ингаляционные глюкокортикостероиды, β2-агонисты, холинолитики, метилксантины). Пациенты, получающие САВ, могут быть вакцинированы по эпидемиологическим показаниям АДС-М, АДС, противополиомиелитной вакциной через 2-4 нед после очередной дозы аллергена с последующим продолжением САВ через 4-5 нед после вакцинации в дозе, предшествующей профилактической прививке.
Эффективность САВ доказана в двойных слепых плацебо контролируемых исследованиях, однако может быть весьма вариабельной в зависимости от вида сенсибилизации, вида и качества вводимых аллергенов; числа вводимых аллергенов; способа введения аллергенов; количества и продолжительности курсов лечения; возраста и индивидуальных особенностей пациента; нозологической формы атопического заболевания. Наиболее высокая эффективность САВ (до 80-90% хороших результатов) отмечается при поллинозе, аллергическом риноконъюнктивите, инсектной аллергии. При атопической форме бронхиальной астмы эффективность лечения составляет 70-75%.
Анализ литературных данных об эффективности и безопасности применения САВ у детей позволяет утверждать, что раннее проведение САВ уменьшает развитие дополнительной сенсибилизации у моносенсибилизированных детей, снижает риск формирования бронхиальной астмы у детей с аллергическим ринитом; при успешном проведении САВ достигается длительная ремиссия у 95% больных с бронхиальной астмой и у 82% детей с аллергическим ринитом, уменьшается объем медикаментозной терапии.
В последние годы пересматриваются взляды на возрастные аспекты проведения САВ у детей. Так, в работах зарубежных авторов (N. Rodrigues Perez, Ambriz Moreno Mde, 2006; L. Cox, L. Jacobsen,
E. Valovita, 2007) показана эффективность и безопасность применения САВ у детей с 2-летнего возраста. В связи с отсутствием повышенного риска развития системных реакций при проведении САВ у детей с 2 лет по сравнению с детьми старше 5 лет, высокой эффективностью лечения и наличием выраженного профилактического эффекта САВ как способа вторичной профилактики респираторной аллергии, этот метод рекомендуется использовать у детей с более раннего возраста (с 2 лет).
Опыт применения САВ в детских клиниках Института педиатрии, акушерства и гинекологии АМН Украины также показал высокую эффективность и безопасность данного метода у детей с аллергическими заболеваниями. С 2000 по 2007 год под нашим наблюдением находилось 78 детей в возрасте 5-14 лет с атопической формой бронхиальной астмы легкой и средней степени тяжести в сочетании с аллергическим ринитом, которым в условиях стационара ускоренным методом проведена САВ аллерговакциной, состоящей из 3-5 аллергенов домашней пыли различных серий, а также обогащенной клещами домашней пыли D. pteronissimus, D. farinae). Критериями эффективности проводимого лечения были частота и тяжесть симптомов заболевания, наличие обострений, потребность и объем медикаментозного лечения. Проведенный анализ результатов лечения показал, что после одного курса подкожной САВ по ускоренной методике положительный результат отмечен у 76,9% детей, которые имели контролируемое течение бронхиальной астмы и отсутствие симптомов аллергического ринита на протяжении года. У 23,1% наблюдаемых детей отмечено уменьшение объема медикаментозного лечения на фоне улучшения течения бронхиальной астмы и аллергического ринита. Среди всех наблюдаемых детей у 4 (5,12%) регистрировались легкие местные реакции.
Таким образом, САВ является достаточно эффективным и безопасным методом лечения атопических заболеваний у взрослых и детей. САВ позволяет изменить патофизиологические механизмы развития аллергических заболеваний, предотвратить дальнейшее расширение спектра сенсибилизации у пациентов, уменьшить объемы медикаментозной нагрузки, улучшить течение атопических заболеваний. Учитывая эффективность метода, САВ должна широко использоваться врачами-аллергологами в повседневной практике.
Литература
1. Белоглазов А.П. Иммунотерапия аллергенами. 2007.
2. Выхристенко Л.Р., Новиков Д.К., Колосова Т.С. Пероральная специфическая аллерговакцинация при атопических заболеваниях. 2007.
3. Горячкина Л.А., Астафьева Н.Г. Специфическая иммунотерапия атопических заболеваний. 2008.
4. Емельянов А.В. Специфическая иммунотерапия. // Общая аллергология. Т.1 под ред. Г.Б. Федосеева. С.-Пб., Нормед-Издат, 2001: 682-93.
5. Ласиця О.І., Недельська С.М. Специфічна вакцинація алергенами у дітей / Методичні рекомендації для лікарів-інтернів, лікарів загальної практики та лікарів-алергологів, 2002. – 44 с.
6. Abramson M., Puy R., Weiner J. Immunotherapy in asthma: an updated systematic review. // Allergy, 1999; 54: 1022-41.
7. Akdis C., Dlaser K. Mechanism of allergen-specific immunotherapy. // Allergy, 2000; 55: 522-30.
8. Van Nerrven R. The role of allergen-specific T-cells in the allergic immune response relevance to allergic vaccination. // Allergy, 1999; 54: 552-61.
9. Bousquet J. Specific immunotherapy in asthma. // Allergy, 1999, 51: 37-8.
10. Nelson HS Effecacy and safety of allergen immunotherapy in children //Ann Allergy Asthma Immunol. 2006 96(2Suppl 1): S2-5.
11. Nuhoglu Y. et al. // J Investig Allergol Clin Immunol, 2007, 17(6), 375-8
12. Rodrigues Perez N., Ambriz Moreno Mde J// Rev Allerg Mex, 2006, 53(2), 47-51.
13. Cox L.//Curr Allergy Asthma Res, 2007, 7(6), 410-20.
14. Jacobsen L.,Valovita E. // Curr Opin Allergy Clin Immunol, 2007, 7(6), 556-60.
15. Jacobsen L., Niggemann B., Dreborg S., et al (The PAT investigator group) (2007). Spesific immunotherapy has long-term preventive effect of seasonal and perennial asthma 10 – year follow – up on the PAT study. In: Allergy 62(8), 943-948.
По данным эпидемиологических исследований, атопические (IgE-зависимые) заболевания, такие как атопическая форма бронхиальной астмы, аллергический риноконъюнктивит, крапивница, поллиноз, инсектная аллергия, встречаются у 40-45% населения, причем количество больных во всем мире каждые десять лет удваивается.
Значительные успехи, достигнутые в терапии аллергических заболеваний в последние десятилетия, позволяют хорошо контролировать клиническое состояние больных на протяжении многих лет. Однако фармакотерапия не позволяет полностью излечить больного и изменить прогноз развития респираторной аллергии.
Среди современных методов лечения атопических заболеваний наиболее эффективным является специфическая иммунотерапия аллергенами – аллерговакцинация (САВ). Это единственный метод лечения, способный изменить патофизиологические механизмы атопических заболеваний, остановить формирование более тяжелых их форм на фоне снижения потребления антиаллергических фармакологических препаратов, продлить стойкую ремиссию, а также предотвратить расширение спектра аллергенов, к которым может развиваться сенсибилизация.
Метод CАВ основан на введении в организм больного возрастающих доз аллергена (аллергенной вакцины), к которому установлена повышенная чувствительность, что приводит к уменьшению или полному исчезновению клинических симптомов заболевания.
Всемирная организация здравоохранения совместно с ведущими ассоциациями аллергологов рекомендует вместо терминов «специфическая гипосенсибилизация», «специфическая иммунотерапия», «аллергенспецифическая иммунотерапия» использовать для названия метода иммунотерапии аллергических заболеваний следующие определения: «иммунотерапия аллергенами», «специфическая вакцинация аллергии», «специфическая аллерговакцинация» (WHO Position paper in Allergen Immunotherapy: Therapeutic vaccines for allergic diseases, 1997).
Чтобы приобрести знания, необходимые для проведения САВ, человечеству потребовалось почти 100 лет. В 1819 г. Босток, страдавший сезонным аллергическим ринитом, описал его как сенную лихорадку, предполагая, что заболевание как-то связано с сеном. В 1869 г. Блекли, пытаясь выяснить причину обострений сенной лихорадки, поставил на себе первые кожные пробы, нанося пыльцу на участки кожи с поврежденным эпидермисом. Быстрое развитие воспаления доказало связь сенной лихорадки с пыльцой растений. Эту связь после Блекли многим исследователям пришлось открывать заново. В 1902-1905 гг. Праустниц и Дунбар, страдающие сенной лихорадкой, в сериях экспериментов на себе также пытались выяснить природу этого заболевания и разработать методы лечения. Они получили лошадиную антисыворотку против пыльцы, но потерпели неудачу из-за развития сывороточной болезни. Уже эти эксперименты выявили основные проблемы, связанные с САВ, – возможность тяжелых побочных реакций и сложность дозирования аллергена, которые и были причиной неудач большинства попыток лечебного применения аллергенов. Разрешить эти проблемы удалось английским исследователям Леонарду Нуну и Джону Фримену, которым принадлежит первая публикация в журнале Lancet за 1911 г. о лечебном применении специфической иммунотерапии у 20 больных сенной лихорадкой.
Впервые иммунотерапия аллергенами при астме была использована Кауфилдом в 1921 г.
Т.Р. УманецИммунотерапия аллергенами показана при поллинозе, атопической форме бронхиальной астмы, аллергическом рините, конъюнктивите, инсектной аллергии в фазу ремиссии, когда невозможно прекратить контакт больного с причинно-значимым аллергеном. Необходимыми условиями для проведения САВ являются:
· четкое подтверждение роли аллергена (пыльца растений, бытовые аллергены, клещи домашней пыли, яд перепончатокрылых, грибы, бактерии);
· подтверждение IgE-зависимого механизма сенсибилизации;
· ограниченный спектр причинно-значимых аллергенов (не более трех);
· возраст от 5 до 50 лет.
При лекарственной аллергии САВ назначается крайне редко, в тех случаях, когда препарат жизненно необходим больному (например, инсулин при сахарном диабете). При пищевой аллергии продукт исключается из рациона питания. При эпидермальной аллергии САВ показана в тех случаях, когда исключение контакта с животным связано с изменением профессии (зоотехники, ветеринары, лаборанты и т.п.) или тяжелой психологической травмой при расставании с животным.
Эффективность метода снижается при низкой индивидуальной мотивации пациента, большой продолжительности аллергического заболевания, у пациентов старше 50 лет, при значительных вентиляционных нарушениях (показатели ниже 70% от должных величин); при поливалентной аллергии.
Противопоказаниями к проведению САВ являются: обострение основного аллергического заболевания, наличие выраженных осложнений основного аллергического процесса (эмфизема легких, пневмосклероз), легочное сердце с явлениями хронической дыхательной или сердечной недостаточности, беременность, опухоли, хронические инфекции в стадии обострения (туберкулез, бруцеллез, сифилис и др.), аутоиммунные заболевания (ревматизм в фазе обострения, коллагенозы и т.д.), тяжелые заболевания внутренних органов, нервной и эндокринной систем с нарушением их функций (например, язвенная болезнь желудка и двенадцатиперстной кишки, панкреатит, гепатит, цирроз печени, гломерулонефрит, декомпенсированный сахарный диабет, облитерирующий эндартериит, рассеянный склероз), психические заболевания в фазе обострения, острые инфекционные заболевания, заболевания крови.
Несмотря на то что САВ применяется более 80 лет, механизмы ее полностью не выяснены и продолжают уточняться. Многие исследователи связывают эффект САВ с увеличением концентрации IgG4, IgG1 и уменьшением синтеза IgE.

В соответствии с современными представлениями продукция IgE или IgG при иммунном ответе определяется хелперными Т-лимфоцитами (Th- или CD4+ лимфоциты), которые в результате распознавания антигена могут дифференцироваться из Th-0 в Th-клетки 1 или 2 типа. Th-1 опосредованный вариант ответа приводит к продукции IgG-антител. Цитокины Th-1 (интерлейкин-2 и интерферон) способствуют дифференцировке Th-0 в Th-1 и подавляют образование Th-2. При атопии наблюдается преимущественная дифференцировка пролиферирующих Th-0 лимфоцитов в Th-2. Th-2 клетки участвуют в запуске и поддержании продукции IgE-антител. Th-2, тучные клетки, эозинофилы с помощью сходного профиля цитокинов (IL-4, IL-5, IL-13), мембраносвязанных молекул (gp 39) и секретируемых В-лимфоцитами IgE-антител создают сеть взаимонаправленных позитивных сигналов, поддерживающих аллергическое воспаление. Цитокины Th-2 (IL-4, IL-13, IL-5) способствуют дифференцировке Th-2 и подавляют Th-1.
При САВ отмечается повышение содержания клеток, продуцирующих IL-12, усиление экспрессии HLA-DR (антигенпредставляющие клетки), появление рецепторов для IL-2, появление Th-1 клеток, переключение Th-2 ответа на Th-1 ответ, что приводит к переключению с IgE-иммунного ответа на IgG-ответ, то есть к запуску и поддержанию продукции IgG-антител (блокирующих) или формированию Т-лимфоцитарной толерантности. Степень соответствия САВ классическим моделям толерантности остается предметом изучения и дискуссий. САВ действует практически на все патогенетически значимые звенья аллергического процесса, оказывает тормозящее действие на клеточный и медиаторный компоненты аллергического воспаления, тормозит раннюю и позднюю фазу IgE-опосредованной аллергии. САВ оказывает действие на вызванную аллергеном продукцию цитокинов воспаления, включая IL-4 и интерферон. При САВ угнетаются эффекторные звенья аллергического процесса: уменьшается содержание тучных клеток, угнетается накопление клеток воспаления (эозинофилов и нейтрофилов), что, в свою очередь, приводит к угнетению накопления в тканях организма больного медиаторов воспаления, высвобождаемых из этих клеток, к уменьшению секреции хемотаксических посредников, инициирующих позднюю фазу аллергического воспаления и неспецифическую тканевую реактивность. Возникающие при САВ изменения характера представительства цитокиновых маркеров, снижение тканевой (органной) чувствительности к экспозиции аллергена, снижение неспецифической тканевой гиперреактивности, угнетение признаков аллергического воспаления сохраняются на протяжении длительного времени.
Ряд исследователей подтвердили важную роль в механизмах САВ секреторных IgА- и IgG-антител, которым также отводится роль блокирующих антител, причем их уровень возрастает при применении локальных методов аллерговакцинации. В процессе САВ возможно образование антиизотипических антител, то есть анти-IgЕ-антител.
Совокупность перечисленных механизмов определяет специфический компонент аллерговакцинации.
Однако наряду с иммунологическими механизмами САВ возможны и неиммунологические. Это прежде всего активация ферментных систем клеток и тканей, усиление их роли в деградации и утилизации аллергенов. В пользу неиммунологических механизмов САВ свидетельствует возможность десенсибилизации аспирином при аспириновой астме. По-видимому, успех десенсибилизации обусловлен биохимическими механизмами, уменьшающими биологические эффекты лейкотриенов, возникающие вследствие нарушения метаболизма арахидоновой кислоты.
Таким образом, преимущества САВ обусловлены терапевтическим действием, которое распространяется на все этапы аллергического ответа; такая широта отсутствует у известных фармакологических препаратов.
Анализ данных о САВ показывает, что эффективность метода может быть вариабельной и зависит от вида сенсибилизации, свойств и числа вводимых аллергенов, способа их введения, количества курсов лечения и других факторов.
С целью повышения клинической эффективности аллерговакцинации и уменьшения риска развития побочных реакций современные исследования направлены на улучшение качества аллергенов. Качество аллергенной вакцины имеет решающее значение как для диагностики, так и для лечения. По возможности для иммунотерапии аллергенами должны быть использованы стандартизированные вакцины с известной силой действия и с учетом срока годности.
Аллергенные вакцины (терапевтические вакцины для аллергических заболеваний) представляют собой очищенные водно-солевые экстракты аллергенов или выделенные из них отдельные аллергенные компоненты. В соответствии с требованиями Европейской фармакопейной конвенции, позицией ВОЗ и Комитета по стандартизации аллергенов при Международном Союзе иммунологических обществ терапевтические вакцины для аллергических заболеваний стандартизируются по своей биологической активности (международные единицы – МЕ). С целью контроля качества аллергенов для лечения используются международные эталоны или внутренние референс-препараты (in house reference – IHR). Стандартизация аллергенной активности основана на тестах in vitro, определяющих IgE-ответ, и на тестах in vivo – кожные пробы с учетом гистаминового эквивалента.
Для дозирования лечебных доз применяют единицы NOON (объем АГ, который экстрагируют из 1 мкг пыльцы), общего (TNU) или белкового (PNU) азота. 1 PNU равна 0,00001 мг белкового азота в 1 мл. Примерная эквивалентность 1 PNU = 2,6 TNU = 2 ед. NOON.
Проводится систематическая идентификация аллергенов различного происхождения. В настоящее время общий список аллергенов и описание их свойств размещены на сайте www.allergen.org.
С целью усиления иммуногенных свойств лечебных вакцин для лечения аллергических заболеваний используют аллергены пролонгированного действия с использованием природных и синтетических носителей, депонированные на L-тирозине, гидроокиси алюминия; аллергоиды (аллергены, модифицированные полимеризацией формальдегидом, глутаровым альдегидом и др.). При этом основной задачей модификации молекулы вакцины является снижение способности связываться со специфическими IgE (снижение аллергенности) при сохранении или даже повышении эффективного связывания с эпитопами Т-клеток, которое определяет иммуногенность молекулы.
В последние годы для проведения специфической вакцинации используют конъюгаты очищенных аллергенов с синтетическими высокомолекулярными носителями, например полиоксидонием (Р.В. Петров и соавт.), сукцинилированные (обработанные янтарной кислотой) и потенцированные ферментами (β-глюкуронидазой) препараты; изучаются возможности применения аллерген-IgG-содержащих комплексов, IgE-связывающих аллергенных гаптенов, Fab-фрагментов моноклональных анти-IgE-антител, фрагментов молекул аллергенов, сохраняющих Т-клеточные эпитопы (использование десенсибилизации, потенцированной ферментом enzyme-potentiated desensitization – EPD).
Еще одним принципиально новым направлением САВ является вакцинация ДНК, кодирующей аллерген. ДНК-вакцинация вызывает преимущественно ответ по Тh-1-типу. Вместе с тем имеются опасения, что слишком интенсивное образование аллергена трансфецированными клетками может приводить к анафилаксии. Хотя большая часть описанных выше биотехнологических подходов к созданию аллергенов для САВ носит экспериментальный характер, часть разработок уже завершилась созданием применяемых в клинике препаратов. Это вакцины серии Pollinex Quattro (Allergy Therapeutics), Allergovit (Allergopharma). Модификация аллергенов дает возможность сократить длительность курса иммунотерапии
до 4-8 инъекций, в то время как при использовании обычных немодифицированных вакцин курс лечения требует
от 16 до 50 инъекций.
В Украине выпуск стандартизированных препаратов аллергенов налажен в Виннице предприятием «Иммунолог» под руководством профессора Б.М. Пухлика, что обеспечивает возможность широкого применения аллергенов для диагностики и САВ.
Основной опасностью иммунотерапии аллергенами являются анафилактические реакции. Следовательно, иммунотерапия аллергенами должна проводиться только в аллергологических кабинетах под наблюдением врача-аллерголога, который может распознать ранние симптомы и признаки анафилактической реакции и назначить соответствующую неотложную терапию.
Различают местные и общие побочные реакции при проведении САВ. Общие побочные реакции обычно связаны с нарушением правил проведения САВ: превышение дозы вводимого аллергена, проведение лечения необученным персоналом, неправильная техника введения аллергена, попадание аллергена непосредственно в сосуд, введение аллерговакцины на фоне недиагностированной интеркуррентной инфекции, отсутствие контроля за жизненно важными показателями перед вакцинацией (АД, пульс, фоновый уровень пика экспираторного потока). Они должны быть конституциональными и системными. Последние развиваются через 10-40 мин после инъекции аллергена и проявляются симптомами разной степени тяжести: от умеренно выраженных (кашля, чихания, головной боли, крапивницы, отека лица) до синдромной реакции со стороны шоковых органов (конъюнктивита, ринита, приступа бронхиальной астмы). Частота общих реакций колеблется от 0,1 до 21%. Конституциональная реакция может проявляться анафилактическим шоком. Летальные случаи при правильном проведении САВ – казуистика. Но в Великобритании, где САВ проводили врачи общей практики, а не аллергологи, с 1957 по 1986 год описано 26 летальных исходов вследствие САВ. Наступление летальных исходов связано с несвоевременным началом антианафилактических мероприятий, отсутствием противошокового набора.
Местные побочные реакции выражаются образованием на месте инъекции отека, иногда обширного, безболезненного, с явлениями легкого зуда и гиперемии. Опасности для пациента они не представляют, проходят самостоятельно под действием антигистаминных средств и/или локальных глюкокортикостероидов в течение нескольких часов. Частота возникновения – до 25-35%.
В зависимости от способа введения аллергена различают подкожный, внутрикожный, аппликационный методы и метод кожных квадратов; оральную, сублингвальную, интраназальную, конъюнктивальную, ингаляционную САВ. В настоящее время единственным методом САВ, одобренным FDA, является подкожный.
На современном этапе большое внимание уделяется пероральным методам введения аллергена, особенно сублингвальному, который позволяет значительно снизить вероятность развития побочных реакций при САВ. Анализ литературных данных позволяет выделить ряд преимуществ сублингвальной САВ: высокая эффективность и безопасность лечения, удешевление за счет отмены инъекционных процедур, удобство и безболезненность лечения, высокий комплайенс врача и пациента.
В зависимости от продолжительности курсов выделяют круглогодичную, предсезонную, сезонную САВ, выбор определяется этиологией аллергического заболевания.
При бытовой аллергии проводят круглогодичное лечение. Предсезонную САВ используют преимущественно при поллинозах и всегда – при аллергических реакциях на укусы насекомых. Круглогодичное введение пыльцевых аллергенов (с уменьшением дозы вводимого аллергена в период поллинации) дает лучший клинический эффект.
Для каждого больного после тщательной аллергодиагностики подбирается индивидуальная схема лечения. Классический метод заключается в подкожном введении вне периода обострения аллергена серийного производства, содержащего в 1 мл 10 000-20 000 PNU. Начальная доза подбирается путем аллергометрического титрования. Аллерген в разведении с 10-6 до 10-4 вводится в дозе 0,1-0,2-0,4-0,8 мл ежедневно или через день. Затем следуют разведения от 10-3 до 10-1 в дозе 0,1-0,2-0,3-0,4-0,5-0,6-0,7-0,8-0,9 мл с интервалами 7-10 дней с последующим введением поддерживающей дозы (как правило, 1000-1500 ед.). Особенно удобным для больного является метод ускоренной САВ, позволяющий сократить сроки аллерговакцинации. Эта методика проводится только в условиях стационара.
САВ хорошо сочетается с базисной и симптоматической терапией аллергических заболеваний (антигистаминные препараты, кромогликат, недокромил, ингаляционные глюкокортикостероиды, β2-агонисты, холинолитики, метилксантины). Пациенты, получающие САВ, могут быть вакцинированы по эпидемиологическим показаниям АДС-М, АДС, противополиомиелитной вакциной через 2-4 нед после очередной дозы аллергена с последующим продолжением САВ через 4-5 нед после вакцинации в дозе, предшествующей профилактической прививке.
Эффективность САВ доказана в двойных слепых плацебо контролируемых исследованиях, однако может быть весьма вариабельной в зависимости от вида сенсибилизации, вида и качества вводимых аллергенов; числа вводимых аллергенов; способа введения аллергенов; количества и продолжительности курсов лечения; возраста и индивидуальных особенностей пациента; нозологической формы атопического заболевания. Наиболее высокая эффективность САВ (до 80-90% хороших результатов) отмечается при поллинозе, аллергическом риноконъюнктивите, инсектной аллергии. При атопической форме бронхиальной астмы эффективность лечения составляет 70-75%.
Анализ литературных данных об эффективности и безопасности применения САВ у детей позволяет утверждать, что раннее проведение САВ уменьшает развитие дополнительной сенсибилизации у моносенсибилизированных детей, снижает риск формирования бронхиальной астмы у детей с аллергическим ринитом; при успешном проведении САВ достигается длительная ремиссия у 95% больных с бронхиальной астмой и у 82% детей с аллергическим ринитом, уменьшается объем медикаментозной терапии.
В последние годы пересматриваются взляды на возрастные аспекты проведения САВ у детей. Так, в работах зарубежных авторов (N. Rodrigues Perez, Ambriz Moreno Mde, 2006; L. Cox, L. Jacobsen,
E. Valovita, 2007) показана эффективность и безопасность применения САВ у детей с 2-летнего возраста. В связи с отсутствием повышенного риска развития системных реакций при проведении САВ у детей с 2 лет по сравнению с детьми старше 5 лет, высокой эффективностью лечения и наличием выраженного профилактического эффекта САВ как способа вторичной профилактики респираторной аллергии, этот метод рекомендуется использовать у детей с более раннего возраста (с 2 лет).
Опыт применения САВ в детских клиниках Института педиатрии, акушерства и гинекологии АМН Украины также показал высокую эффективность и безопасность данного метода у детей с аллергическими заболеваниями. С 2000 по 2007 год под нашим наблюдением находилось 78 детей в возрасте 5-14 лет с атопической формой бронхиальной астмы легкой и средней степени тяжести в сочетании с аллергическим ринитом, которым в условиях стационара ускоренным методом проведена САВ аллерговакциной, состоящей из 3-5 аллергенов домашней пыли различных серий, а также обогащенной клещами домашней пыли D. pteronissimus, D. farinae). Критериями эффективности проводимого лечения были частота и тяжесть симптомов заболевания, наличие обострений, потребность и объем медикаментозного лечения. Проведенный анализ результатов лечения показал, что после одного курса подкожной САВ по ускоренной методике положительный результат отмечен у 76,9% детей, которые имели контролируемое течение бронхиальной астмы и отсутствие симптомов аллергического ринита на протяжении года. У 23,1% наблюдаемых детей отмечено уменьшение объема медикаментозного лечения на фоне улучшения течения бронхиальной астмы и аллергического ринита. Среди всех наблюдаемых детей у 4 (5,12%) регистрировались легкие местные реакции.
Таким образом, САВ является достаточно эффективным и безопасным методом лечения атопических заболеваний у взрослых и детей. САВ позволяет изменить патофизиологические механизмы развития аллергических заболеваний, предотвратить дальнейшее расширение спектра сенсибилизации у пациентов, уменьшить объемы медикаментозной нагрузки, улучшить течение атопических заболеваний. Учитывая эффективность метода, САВ должна широко использоваться врачами-аллергологами в повседневной практике.
Литература
1. Белоглазов А.П. Иммунотерапия аллергенами. 2007.
2. Выхристенко Л.Р., Новиков Д.К., Колосова Т.С. Пероральная специфическая аллерговакцинация при атопических заболеваниях. 2007.
3. Горячкина Л.А., Астафьева Н.Г. Специфическая иммунотерапия атопических заболеваний. 2008.
4. Емельянов А.В. Специфическая иммунотерапия. // Общая аллергология. Т.1 под ред. Г.Б. Федосеева. С.-Пб., Нормед-Издат, 2001: 682-93.
5. Ласиця О.І., Недельська С.М. Специфічна вакцинація алергенами у дітей / Методичні рекомендації для лікарів-інтернів, лікарів загальної практики та лікарів-алергологів, 2002. – 44 с.
6. Abramson M., Puy R., Weiner J. Immunotherapy in asthma: an updated systematic review. // Allergy, 1999; 54: 1022-41.
7. Akdis C., Dlaser K. Mechanism of allergen-specific immunotherapy. // Allergy, 2000; 55: 522-30.
8. Van Nerrven R. The role of allergen-specific T-cells in the allergic immune response relevance to allergic vaccination. // Allergy, 1999; 54: 552-61.
9. Bousquet J. Specific immunotherapy in asthma. // Allergy, 1999, 51: 37-8.
10. Nelson HS Effecacy and safety of allergen immunotherapy in children //Ann Allergy Asthma Immunol. 2006 96(2Suppl 1): S2-5.
11. Nuhoglu Y. et al. // J Investig Allergol Clin Immunol, 2007, 17(6), 375-8
12. Rodrigues Perez N., Ambriz Moreno Mde J// Rev Allerg Mex, 2006, 53(2), 47-51.
13. Cox L.//Curr Allergy Asthma Res, 2007, 7(6), 410-20.
14. Jacobsen L.,Valovita E. // Curr Opin Allergy Clin Immunol, 2007, 7(6), 556-60.
15. Jacobsen L., Niggemann B., Dreborg S., et al (The PAT investigator group) (2007). Spesific immunotherapy has long-term preventive effect of seasonal and perennial asthma 10 – year follow – up on the PAT study. In: Allergy 62(8), 943-948.
Иллюстрация к статье:
Подписывайтесь на наш Telegram, чтобы быть в курсе важных новостей медицины
Добавил slava в категорию Дерматология

Добавить комментарий